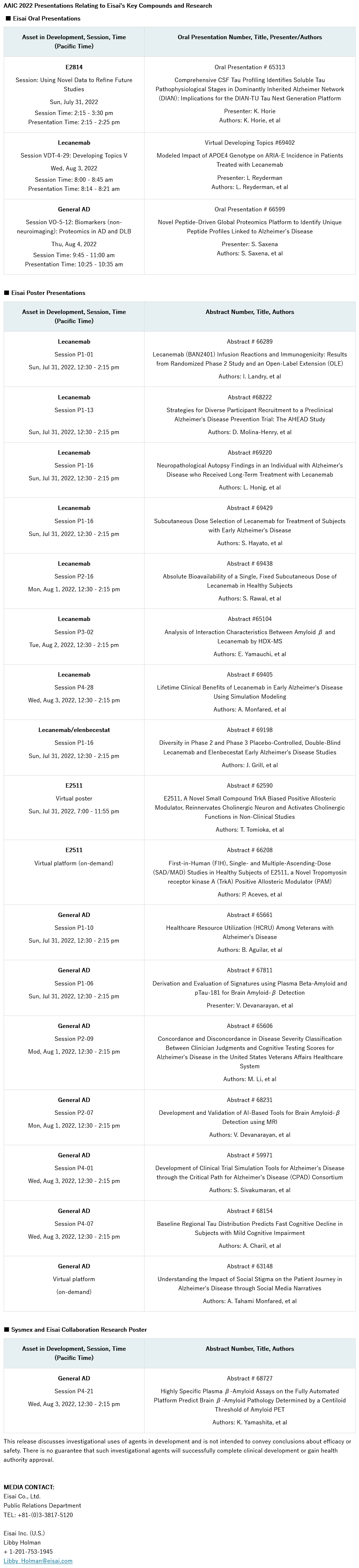
第二篇使用模拟模型研究lecanemab治疗早期阿尔茨海默病患者的潜在价值的文章
卫材株式会社(总部:东京,首席执行官:内藤晴夫,以下简称“卫材”)今日宣布其在同行评议期刊《神经病学与治疗》上发表了一项早期评估的结果,该评估旨在使用经验证的疾病模拟模型–ad archimedes condition event(ad ace)模型1,2,3,从美国医保支付方和社会的角度来估计抗β淀粉样蛋白(aβ)原纤维抗体lecanemab在治疗早期阿尔茨海默病(ad)患者的潜在经济价值。这是第二篇关于lecanemab潜在价值的文章,上一篇是关于使用模拟模型对lecanemab的长期健康结局进行评价,于2022年4月在《神经病学与治疗》上发表4。医保支付方角度重点关注直接护理费用(如门诊和住院服务、药物、干预治疗费用、疗养院和居家医疗保健服务),社会角度则进一步考虑了社会成本(如生产力损失和非正式护理费用)。如之前一篇文章所述,与标准治疗*(soc)相比,在soc基础上加用lecanemab(lecanemab soc)治疗的个体从基线到轻度、中度和重度ad的疾病进展可能会减缓,平均减缓时间分别为2.51年、3.13年和2.34年。这种基于模型的模拟初步结果可能会延长质量调整生命年(qaly**),并减少正式和非正式护理费用***。此外,本研究中使用的ad ace模型框架有助于评估lecanemab在不同情况下的潜在价值以及进行敏感性分析,包括患者子集、替代治疗停止规则****、潜在给药方案以及主要不确定性来源的影响。
卫材研发的lecanemab,旨在改善脑中已存在淀粉样病变的早期ad患者的预后,同时致力于开展和分享相关研究的临床分析和社会经济学分析。为此,卫材希望为利益相关者从社会角度讨论lecanemab的潜在临床价值和社会经济学价值提供基础,并暂时不为lecanemab定价。
这一基于模型的模拟利用了iib期临床试验(研究201)的结果,该试验评价了lecanemab用于已存在淀粉样病变的早期ad患者的疗效和安全性,并已发表。其还根据临床和经济审查研究所(icer)*****的建议,在广泛的支付意愿阈值范围(50,000美元-200,000美元/qaly)内估计了lecanemab soc的潜在经济价值。从医保支付方角度来看,对于确认存在淀粉样病变的早期ad患者来说,相比于soc,预计lecanemab soc将增加0.61 qaly,非治疗总费用将减少8,707美元/人(社会角度:增加0.64 qaly,减少11,214美元)。根据这一早期经济评价,估计lecanemab的潜在年度价值导向定价(vbp)为9,249-35,605美元(社会角度:10,400-38,053美元)。
icer的价值框架5表明,不能仅根据临床和成本效益指标来衡量价值,因此在评估长期价值时,还要在框架中加入对背景因素以及其他获益和不利因素的考量。相对于直接医疗费用而言,ad还给社会造成了巨大负担,这可能导致在估计lecanemab的合理价格时采用社会视角并提高广泛支付意愿阈值范围的上限。
许多ad患者接受了家人和朋友的非正式护理,2021年美国无偿护理总时间超过160亿小时,价值2716亿美元6。这些预测和模拟结果表明,早期使用lecanemab治疗可能会减少此类成本和经济负担,并为医疗保健决策者提供有关lecanemab潜在临床和社会经济学价值的深刻见解。我们很快就能获得lecanemab iii期clarity ad研究的数据,从而为模型输入提供信息并完善研究结果。如果lecanemab获得美国食品药品监督管理局(fda)的批准,卫材可能会使用这个框架以及其他考虑因素(如可负担性、卫生系统的可持续性等)来确定vbp。
卫材株式会社高级副总裁、神经系统疾病研发业务总裁兼全球阿尔茨海默病负责人、卫材美国董事长兼首席执行官ivan cheung表示:“卫材的目标是创造新疗法,比如我们的抗β淀粉样原纤维抗体lecanemab,这可能有助于减轻阿尔茨海默病患者及其家人的焦虑。对于阿尔茨海默病,重要的是评价疗法的整体价值,不仅要考虑医疗成本,还要考虑巨大的社会成本。作为卫材“关心人类健康使命、信任和透明度”承诺的一部分,我们将继续公布有关lecanemab的数据和信息,并期待今年秋季能够分享lecanemab验证性iii期clarity ad临床试验的结果。”
卫材于2022年5月在加速批准通道下完成向fda滚动提交lecanemab治疗早期ad的生物制品许可申请(bla)。lecanemab治疗早期ad的iii期clarity ad临床研究正在进行中,并于2021年3月完成招募,共入组1795名患者。clarity ad研究的主要终点数据将于2022年秋季公布。fda已经同意,在clarity ad研究完成后可将所得结果作为确证性研究的结果,以验证lecanemab的临床获益。卫材可能于2022财年内(截至2023年3月)向fda提交lecanemab的全面批准申请(具体取决于clarity ad临床试验的结果)。2022年3月,卫材开始在日本根据事先评估咨询制度向药品和医疗器械管理局(pmda)提交申请数据,以使lecanemab尽早获批,并将根据卫材2022财年内clarity ad研究的结果申请生产和上市许可。另外,根据clarity ad研究的结果,卫材计划于2022财年在欧洲提交新药申请。
本新闻稿讨论的是正在开发的药物的研究用途,无意传达关于疗效或安全性的结论。我们并不保证此试验用药物将成功完成临床开发或获得卫生当局的批准。
*ad的标准治疗(soc)目前包括生活方式调整和症状的药物治疗。
**质量调整生命年(qaly)是一种衡量健康结局的指标。由于健康是生命长度(即数量)和生活质量(qol)的函数,qaly的产生则是为了将这些属性的值合并为一个个体指数。一个qaly等于处于完全健康状态的一年。qaly评分范围从1(完全健康)至0(死亡)。例如,一项新的干预措施可能会增加3年的寿命,并将生活质量改善70%(qaly评分为2.1),而现有的干预措施可能会增加3年的寿命,但qol 仅可改善50%(qaly评分为1.5),所以这项新干预措施的增量qaly将为0.6 qaly。
***正式和非正式护理费用不包括lecanemab药物费用。
****在情景分析中探讨了替代的治疗停止规则,即在1.5年、3年和5年的固定期限后停止lecanemab治疗。
*****icer是美国的一家非营利性研究组织,专注于评估处方药、医疗测试、器械和卫生系统提供创新的临床和经济价值证据。
1 kansal ar, tafazzoli a, ishak kj, krotneva s. alzheimer’s disease archimedes condition-event simulator: development and validation.alzheimers dement (ny).2018;4:76-88.published 2018 feb 16. doi:10.1016/j.trci.2018.01.001.
2 tafazzoli and kansal. disease simulation in drug development, external validation confirms benefit in decision making.the evidence forum.2018.
https://www.evidera.com/wp-content/uploads/2018/10/07-disease-simulation-in-drug-development_fall2018.pdf
3 tafazzoli a, weng j, sutton k, et al. validating simulated cognition trajectories based on adni against 436 trajectories from the national alzheimer’s coordinating center (nacc) dataset.11th edition of clinical trials on 437 alzheimer’s disease (ctad); barcelona, spain: 2018.
4 tahami monfared aa, tafazzoli a, ye w, chavan a, zhang q. long-term health outcomes of lecanemab in patients with early alzheimer’s disease using simulation modeling. neurol ther 11, 863–880 (2022). https://link.springer.com/article/10.1007/s40120-022-00350-y.
5 icer value framework 2020-2023. 2022.icer_2020_2023_vaf_02032022.pdf
6 alzheimer’s association. 2022 alzheimer’s disease facts and figures 2022 available from: alzheimers-facts-and- figures.pdf.
媒体咨询:
公共关系部,
卫材株式会社
81-(0)3-3817-5120
卫材美国
libby holman
libby_holman@eisai.com
201-753-1945