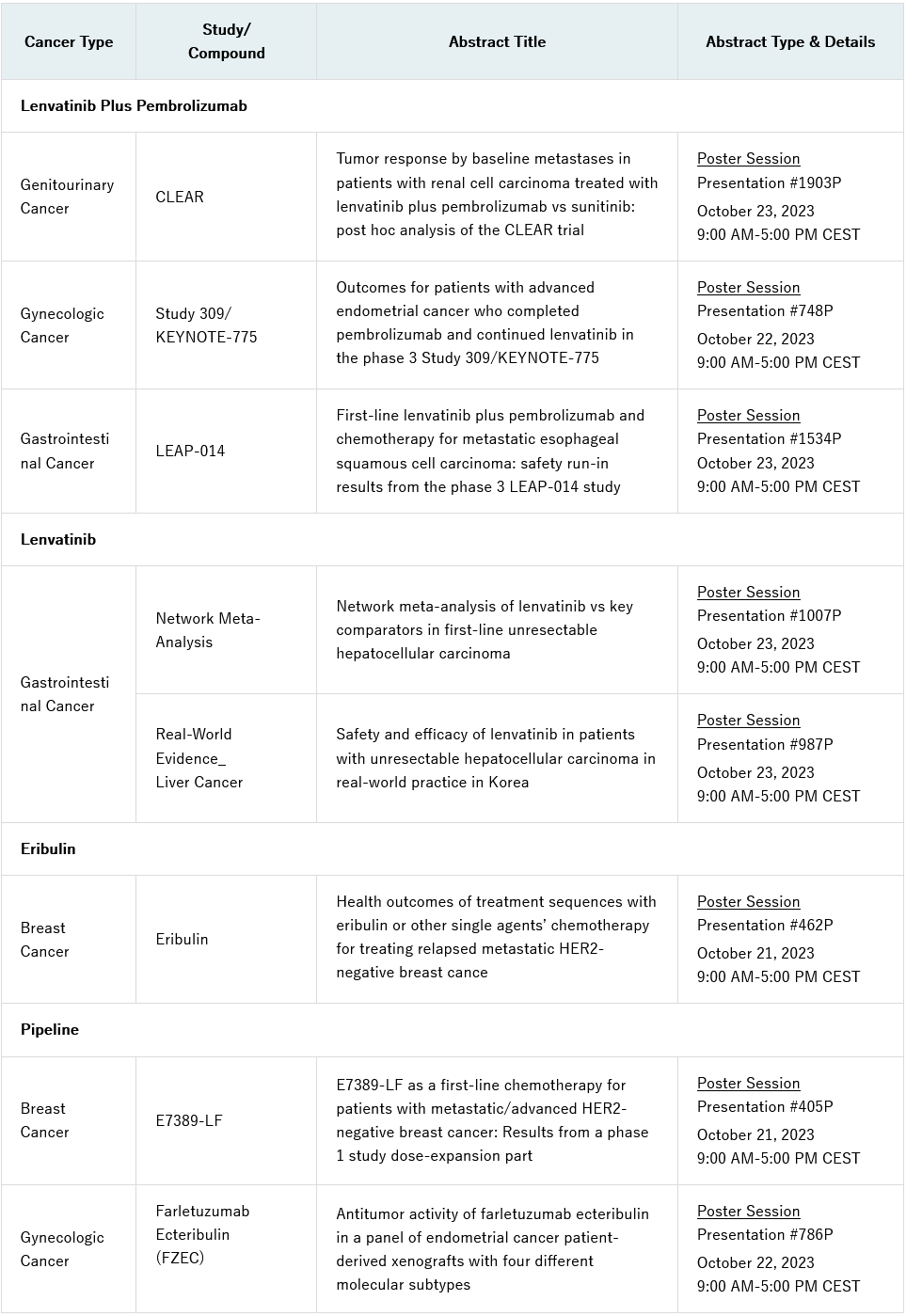
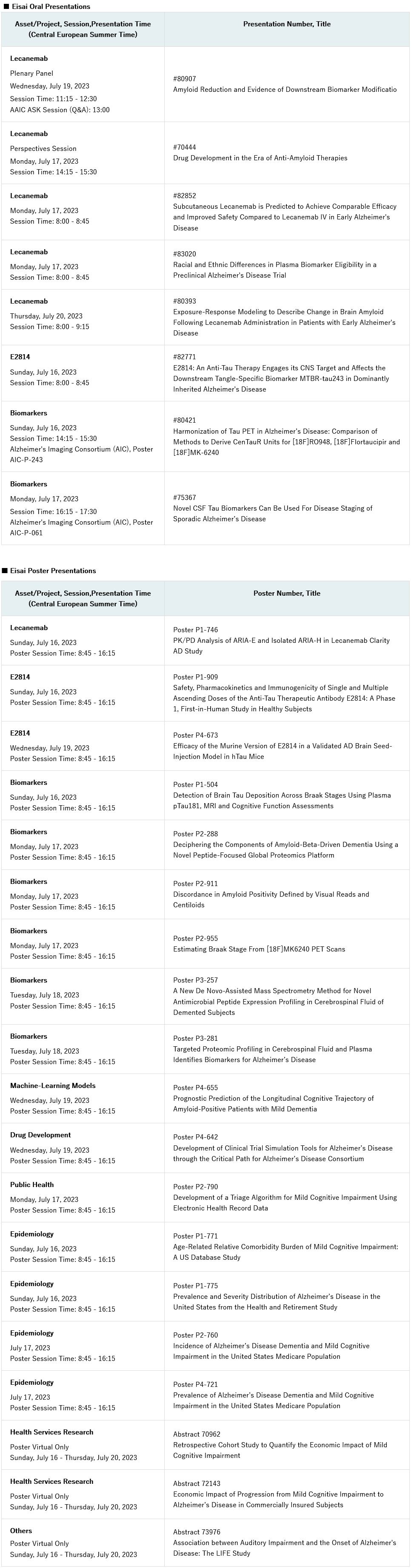
这是首个也是唯一一个被批准的治疗方法,证明其可以降低成人阿尔茨海默病患者的疾病进展的速度,并延缓认知和功能衰退。
美国医疗保险和医疗补助服务中心(cms)宣布扩大leqembi的医疗保险范围。
2023年7月6日–卫材株式会社和渤健公司今天宣布,美国食品药品监督管理局(fda)已经批准leqembi®(lecanemab-irmb)100 mg/ml注射液的补充生物制剂许可申请(sbla),使leqembi成为首个也是唯一一个被批准的治疗方法,证明其可以降低成人阿尔茨海默病(ad)患者的疾病进展速度,延缓认知和功能衰退。在美国医疗保险受益人的患者群体中,leqembi证明了对认知和功能衰退具有临床意义的延缓,该人群包括多个种族和民族,有常见合并症的患者,合并药物治疗的患者,以及ad源性轻度认知障碍(mci)或轻度ad患者。leqembi的治疗应该用于轻度认知障碍或轻度痴呆阶段的患者(统称为早期ad)是在临床试验中开始治疗的人群。
leqembi的传统批准是基于卫材的大型全球clarity ad临床试验的iii期数据。在该试验中,leqembi达到了其主要终点和所有关键次要终点的统计学意义上的结果,并证实了leqembi的临床获益。主要终点是全球认知和功能量表,即临床痴呆症评分总表(cdr-sb)。与安慰剂相比,leqembi治疗在18个月时减少了cdr-sb的临床下降27%。此外,由ad看护者评估的次要终点阿尔茨海默病协作研究组-轻度认知障碍-日常生活能力量表评分(adcs mci-adl)显示出37%的显著统计学获益。这衡量的是患者独立运作的能力,包括能够穿衣、喂食和参与社区活动。clarity ad研究的全部结果在2022年阿尔茨海默病临床试验(ctad)会议上公布,并同时发表在2022年11月29日的同行评审医学杂志《新英格兰医学杂志》上。
重要的是,在fda对leqembi的传统批准之后,cms确认leqembi的覆盖面将扩大,并发布了有关注册表方面的更多细节,包括易于使用的数据提交流程。现在,由cms推动的注册表可供医护人员向cms提交所需的患者数据。卫材很高兴医疗保险将为合适的患者支付这一重要疗法,这将促进美国更多的医疗机构来报销和使用leqembi。
卫材ceo内藤晴夫表示:“今天,fda在传统的审批途径下批准了leqembi,使leqembi成为首个也是唯一一个被批准的抗淀粉样变的阿尔茨海默病治疗药物,证明其可以降低早期和轻度痴呆阶段的疾病进展速度和延缓疾病认知障碍进展。作为一家基于hhc(human health care,关心人类健康)理念、以研发为重点的公司,我们很自豪,卫材在过去40年里,ad研究结果得到了认可,并提供给疾病患者。阿尔茨海默病是一种渐进的、致命的疾病,不仅对患者有很大影响,而且对他们的亲人、看护者和社会也有影响。我们继续努力为患者创造广泛而简单的leqembi使用权,并支持在疾病的早期阶段进行诊断和治疗。卫材将勤奋工作,向医生传播安全和适当地使用leqembi的知识,使其对早期ad患者及其家属的利益最大化。”
渤健总裁兼ceo christopher a. viehbacher表示,“今天标志着阿尔茨海默病的治疗取得了突破性进展,我们很自豪能够站在前列,为这种以前被认为无法治疗的疾病开创一个新的进展时代。我们要向那些为寻找这种无解疾病的治疗方法而不懈努力的人表示衷心的感谢,没有他们就不可能取得这一进展。我们在前进的道路上与卫材公司一起工作,目标是使符合条件的患者尽快可以使用leqembi。”
leqembi是一种人源化免疫球蛋白γ1(igg1)单克隆抗体,针对聚集的可溶性(原纤维*)和不可溶性形式的β淀粉样蛋白(aβ)。重要的是,leqembi针对并清除持续积累的最具神经毒性的aβ形式,并清除现有斑块,以治疗这种渐进的慢性疾病。2023年6月,美国fda周围和中枢神经系统药物(pcns)咨询委员会全票通过,卫材的clarity ad临床试验数据证实了leqembi对治疗ad的临床获益。委员会成员还确认了leqembi的整体风险-获益。2023年1月6日,leqembi在加速审批途径下获得fda批准。
卫材已经开发并部署understanding aria™,这是一个多方面的教育计划,旨在进一步促进ad医疗界对淀粉样蛋白相关成像异常(aria)的实际管理和监测的理解。通过与医学影像领域的专家以及主要的专业协会合作,understanding aria™提供的资源和计划,包括同行教育、个人和团体教育课程以及历史案例研究的主题专家评估等内容。
卫材致力于确保合适的患者能够获得leqembi,并建立了一个患者援助计划,为符合经济需求和其他计划标准的无保险和保险不足的患者(包括医疗保险受益人)免费提供leqembi。此外,卫材还通过leqembi患者领航员项目提供患者支持,以改善获取途径,他们将提供有关获取leqembi的信息,帮助患者及其家属了解他们的保险范围和选择,并为符合条件的患者确定财务支持计划。在美国,人们可以通过访问leqembi.com、在东部时间周一至周五上午8点至晚上8点拨打1-833-4 leqembi(1-833-453-7362)或将注册表传真至1-833-770-7017,了解更多关于这些服务。
leqembi的全球开发和监管提交由卫材主导,而产品则由卫材和渤健共同商业化和推广。其中,卫材拥有最终决策权。
媒体联络:
eisai co., ltd.
public relations department
tel: 81 (0)3-3817-5120
biogen inc.
jack cox
1 781-464-3260
public.affairs@biogen.com
eisai inc. (u.s.)
libby holman
1-201-753-1945
libby_holman@eisai.com
eisai europe, ltd.
(uk, europe, australia, new zealand and russia)
emea communications department
44 (0) 786 601 1272
emea-comms@eisai.net
investor contacts:
eisai co., ltd.
investor relations department
tel: 81 (0) 3-3817-5122
biogen inc.
chuck triano
1-781-464-2442
ir@biogen.com